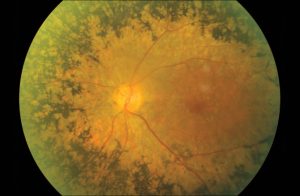
 眼科医清澤のコメント;
眼科医清澤のコメント;
薬価は:0.5mL 1瓶(希釈液2本付)当たり49,600,226円です。
RPE65遺伝子欠損の日本での頻度について:RPE65遺伝子変異による遺伝性網膜ジストロフィーは、希少疾患であり、世界的には約1万人の患者がいると推定されている1。日本では、遺伝性網膜ジストロフィー全体の患者数は約2万人とされている2。RPE65遺伝子変異による遺伝性網膜ジストロフィーの割合は、遺伝性網膜ジストロフィーの原因遺伝子の中で約1%とされています3。したがって、日本でのRPE65遺伝子欠損の患者数は、およそ200人程度と推測できる。
ー眼科疾患における初めての遺伝子補充療法 ー
「ルクスターナ」は、遺伝性網膜ジストロフィーの原因遺伝子の1つであるRPE65遺伝子の機能欠損を補う遺伝子補充療法で、各眼につき網膜下への1回の注射で治療が完了します。正常なRPE65遺伝子を組み込んだ病原性のないアデノ随伴ウイルス2型(AAV2)を利用し、正常なRPE65タンパク質を長時間安定して発現することで、RPE65 遺伝子変異がもたらすRPE65タンパク質の不足によって視覚障害が生じている遺伝性網膜ジストロフィー患者さんに対して視機能の改善をもたらします。
ノバルティス ファーマ株式会社 代表取締役社長レオ・リーは次のように述べています。「対象となる患者さんは非常に希少ですが、日本における眼科疾患で初めての画期的な遺伝子補充療法「ルクスターナ」を提供できることを大変嬉しく思います。これまで治療法がなかったため、暗がりでの活動が制限されたり、視野が狭く、失明の不安を抱えながら生活している患者さんおよびそのご家族の人生を変えられる可能性があります。「ルクスターナ」により明るい未来を提供できることを心より願っています。ノバルティスは、これまで治療不可能であった疾患の治療の可能性を開く細胞・遺伝子治療のような高度な治療プラットフォームの開発とアクセスの確立に取り組んでいます。」
遺伝性網膜ジストロフィーについて
遺伝性網膜ジストロフィーは、進行性の視覚障害を伴う遺伝性網膜疾患の総称です1。その原因となる遺伝子は260以上が同定されています2。そのうちRPE65遺伝子変異による遺伝性網膜ジストロフィーは、暗いところで目がみえにくくなる夜盲や視野が狭くなる視野狭窄、視力低下が主な症状で、進行すると失明に至ることもある希少疾患です3-8。
「ルクスターナ」について
「ルクスターナ」は、両アレル性RPE65遺伝子変異による遺伝性網膜ジストロフィーと診断された、視覚障害があり、十分な生存網膜細胞がある成人及び小児患者さんに対する治療を目的に開発したウイルスベクター製品です。本品の網膜下への単回投与によって、異常な網膜色素上皮細胞へ正常なRPE65遺伝子を導入し正常ヒトRPE65タンパク質を長期間安定して発現させることで、視覚サイクルの機能を回復させ、長期間にわたって視機能が維持されることが期待されます。
本品は両アレル性RPE65遺伝子変異による遺伝性網膜ジストロフィー患者に対するウイルスベクター製品として米国Spark Therapeutics社(Roche社傘下)が開発した遺伝子治療用ベクターで、米国及びEUで、それぞれ2017年12月及び2018年11月に承認されました。なお、ノバルティスは、米国外のすべての国で開発、承認申請および販売に関する独占権を保有します。
本邦においても2023年6月26日、「両アレル性RPE65遺伝子変異による遺伝性網膜ジストロフィー」を効能、効果又は性能として、製造販売承認を取得しました。
製造販売承認取得リリースはこちら
https://www.novartis.com/jp-ja/news/media-releases/prkk20230626
ノバルティス ファーマ株式会社について
ノバルティス ファーマ株式会社は、スイス・バーゼル市に本拠を置く医薬品のグローバルリーディングカンパニー、ノバルティスの日本法人です。ノバルティスは、より充実したすこやかな毎日のために、これからの医薬の未来を描いています。ノバルティスは世界で約10万3千人の社員を擁しており、8億人以上の患者さんに製品が届けられています。ノバルティスに関する詳細はホームページをご覧ください。
https://www.novartis.co.jp
以上
参考文献
1. 日本眼科学会:遺伝性網膜ジストロフィにおける遺伝学的検査のガイドライン遺伝性網膜ジストロフィにおける遺伝学的検査のガイドライン (nichigan.or.jp).
2. Sangermano R, et al.:Genetics and Genomics of Eye Disease.239-258, 2020.
3. Morimura H et al. Proc Natl Acad Sci USA. 1998;95:3088-3093.
4. Ciderciyan AV. Prog Retin Eye Res. 2010;29:398-427.
5. Weleber RG et al. Invest Ophthalmol Vis Sci. 2011;52:292-302.
6. Chacon-Camacho OF et al. World J Clin Cases. 2015;3:112-124.
7. Maguire AM et al. N Engl J Med. 2008;358:2240-2248.
8. Astuti et al, Eur J Hum Genet. 2016;24:1071-9.
<参考資料>
ルクスターナ®注の製品概要
製品名:
「ルクスターナ®注」
一般名:
ボレチゲン ネパルボベク
効能、効果又は性能:
両アレル性RPE65遺伝子変異による遺伝性網膜ジストロフィー
《効能、効果又は性能に関連する使用上の注意》
(1)遺伝学的検査によりRPE65遺伝子の両アレル性の変異が確認された患者に投与すること。
(2)適切な検査により十分な生存網膜細胞を有することが確認された患者に投与すること。
用法及び用量又は使用方法:
通常、1.5×1011ベクターゲノム(vg)/0.3mLを各眼の網膜下に単回投与する。各眼への網膜下投与は、短い投与間隔で実施するが、6日以上あけること。同一眼への本品の再投与はしないこと。
《用法及び用量又は使用方法に関連する使用上の注意》
本品のカプシドタンパク質及びRPE65タンパク質に対する免疫応答のリスク低減を目的とした本品投与前後のプレドニゾロン(又は同等用量の副腎皮質ステロイド)の投与方法
(1) プレドニゾロン(又は同等用量の副腎皮質ステロイド)の投与開始前及び本品の投与前に、感染症の有無を確認し、感染症が認められた場合は投与を中止し、回復してからプレドニゾロン及び本品の投与を行うこと。
(2) 本品を1眼目に投与する3日前から、添付文書記載の表を参考にプレドニゾロンの投与を行うこと。2眼目のプレドニゾロンの投与開始は1眼目のプレドニゾロン投与と同じスケジュールに従い、1眼目のプレドニゾロンの投与が終了していない場合は、2眼目のプレドニゾロンの投与スケジュールを優先する。
承認条件及び期限:
1 . 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用の成績に関する調査を実施することにより、本品使用患者の背景情報を把握するとともに、本品の安全性及び有効性に関するデータを早期に収集し、本品の適正使用に必要な措置を講ずること。
2 . 遺伝性網膜ジストロフィーに関する十分な知識及び経験を有する医師並びに網膜下(黄斑下)手術に関する十分な知識、経験及び技術を有する医師が、本品の臨床試験成績及び有害事象等の知識を十分に習得した上で、遺伝性網膜ジストロフィーの治療に係る体制が整った医療機関において、「効能、効果又は性能」並びに「用法及び用量又は使用方法」を遵守して本品を用いるよう、関連学会との協力により作成された適正使用指針の周知等、必要な措置を講ずること。
3 .「 遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(平成15年法律第97号)」に基づき承認された第一種使用規程を遵守して本品を用いるよう、その使用規程の周知等、必要な措置を講ずること。
承認取得日:
2023年6月26日
薬価基準収載日:
2023年8月30日
発売日:
2023年8月30日
薬価:
0.5mL 1瓶(希釈液2本付)当たり49,600,226円
製造販売(輸入):
ノバルティス ファーマ株式会社
効能、効果又は性能に関連する使用上の注意並びに用法及び用量又は使用方法に関連する使用上の注意は、添付文書をご覧下さい。




コメント