清澤のコメント:腫瘍学と病理学から:精密医療の新たな地平についてという題でパトリシア・チェベス・バリオス医師は、「マルチオミクス」におけるリキッドバイオプシーと人工知能(AI)の使用は、眼内腫瘍の診断、予後、治療における個別化された精密医療を前進させるでしょうと言っています。眼内液中の遺伝子断片で腫瘍が診断できるという魅力的な話で、眼感染症を眼内液で網羅的に診断しようという医科歯科大の望月學前教授のアイデアにつながるものです。これはAAOの発行するEYE NETが、最近の医学の進歩が眼科の各領域をどう変えるかを予測した記事です。リキッドバイオプシーはとても魅力的ですが、今後それを引き受けてくれる医療機関が日本で見つけられるかどうかが問題です。
――――要旨は次の通り―――
- 眼内腫瘍の精密医療:リキッドバイオプシーとAIの使用は、眼内腫瘍の診断、予後、治療における個別化された精密医療を前進させるという主張です。
- リキッドバイオプシー:房水や血液などの体液から腫瘍の無細胞DNAやその他のバイオマーカーを検出する方法です。腫瘍の遺伝子プロファイル、拡大リスク、治療反応などを評価することができます。
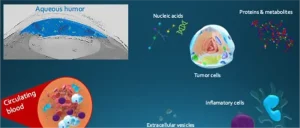
- マルチオミクスとAI:ゲノミクス、エピゲノミクス、プロテオミクス、RNAトランスクリプトミクスなどのオミクスデータにAIを適用することで、精密医療が進歩するという考えです。
- オミクスデータの量と複雑さ:がんは、DNA、RNA、mRNA、タンパク質などの多数のオミックスデータ間の相互作用の結果であると考えられています。これらのデータは、血液などの体液からも得られます。
- デジタル病理スライドとクラウドストレージ:病理学者は、ガラススライドをデジタルスキャナーでスキャンし、デジタルスライドの巨大なデータベースを作成しています。AIは、これらのスライドデータベースを他のデータと組み合わせて、疾患の分類や治療法の提案を行うことができます。
- 精密医療の目標:AIは、患者固有のマルチオミクスデータを考慮して、その患者の診断、予後、治療を提案することができます。これは、個別化医療のポイントです。全員を同じように扱うのではなく、個々の患者に合わせてケアを個別化することです。
――以下の全文訳は読み飛ばしてください―――――――
https://www.aao.org/eyenet/article/a-look-ahead?december-2023
本文の全文訳:腫瘍学と病理学の部分
精密医療の新たな地平
パトリシア・チェベス・バリオス医師
「マルチオミクス」におけるリキッドバイオプシーと人工知能(AI)の使用は、眼内腫瘍の診断、予後、治療における個別化された精密医療を前進させるでしょう。
リキッドバイオプシー
網膜芽細胞腫の小児の眼房水のリキッドバイオプシーを採取する新しいアプローチにより、がん腫瘍の「無細胞」ゲノム配列決定への道が開かれています。1潜在的に致死的な転移性疾患を引き起こす可能性がある腫瘍の拡大リスクのため、従来の針生検は網膜芽細胞腫に対して実行されるべきではないため、これは歓迎すべき開発です。無細胞 DNA (cfDNA) 分析やその他のバイオマーカーをもたらす房水リキッドバイオプシーは、特定の眼内腫瘤の固有の遺伝子プロファイルを特定し、より正確な診断、個別の予後、および個別の治療につながるという点で大きな期待を抱いています。また、末梢血リキッドバイオプシーは、眼内腫瘍の転移性疾患の早期診断と予後診断にも使用され始めています。
予後。房水リキッドバイオプシー(腫瘍細胞を一切傷つけない生検)は、癌性の目を安全かつ首尾よく救える可能性を予測する独自の染色体変化を評価することができます。具体的には、房水中の「6p」と呼ばれる染色体が増加すると、網膜芽細胞腫の眼球摘出が必要になるリスクが10倍増加します。1 6p 染色体のレベルを測定できることは、網膜芽細胞腫の小児を治療する際の臨床上の意思決定を助ける予測バイオマーカーとして大きな可能性を秘めています。同様に、房水中の他のバイオマーカーは、さまざまな眼内腫瘍の予後を予測する価値がある可能性があります。
鑑別診断。房水生検も鑑別診断に役立ちます。伝統的に、眼腫瘍専門医は、悪性および良性の一般的な眼内腫瘍(例、小児の網膜芽細胞腫、成人の転移性腫瘍、ブドウ膜黒色腫、およびリンパ腫)の鑑別診断を行うために眼科的特徴と画像に依存しています。悪性腫瘍患者の標準治療では治療前に生検で証明された診断が必要であるため、これらの新しいリキッドバイオプシーは眼腫瘍学における鑑別診断を大幅に強化します。
たとえば、眼内腫瘍の非典型的な症状を呈する小児(核摘出後に悪性毛様体髄上皮腫と診断された)を対象とした2022年の症例研究では、リキッドバイオプシーの可能性が示されました。この眼から採取された房水生検では、網膜芽細胞腫とは一致しない異なるゲノム特徴が示され、従来の組織学、MRI、Bスキャン超音波、その他の診断技術と比較した場合、眼内病変の鑑別診断におけるリキッドバイオプシーの価値が裏付けられました。2
治療のフォローアップ。これらのリキッドバイオプシーは、腫瘍細胞が治療にどのように反応しているかを明確に示すために複数のポイントで採取することもできます。現在では、DNA の断片だけでなく、メッセンジャー RNA、タンパク質、腫瘍の細胞質の小さな断片である細胞外小胞など、房水中に浮遊する腫瘍のより小さな遺伝マーカーも検出できるようになりました。これにより、針生検のように単一時点で腫瘍を調べるだけでなく、時間をかけて進行性リキッドバイオプシーで房水を「タッピング」して、腫瘍がどのように進行しているかを確認し、治療に対する反応を監視することもできます。房水中のバイオマーカーは腫瘍自体と相関します。
黒色腫の放射線プラーク治療後、腫瘍学者は房水中の腫瘍の DNA を測定することによって治療の成功を評価することもできる可能性があります。減少している場合、腫瘍は死滅しています。
これらすべての潜在的な利点を考慮すると、リキッドバイオプシーはその使用を検証するためにさらに臨床試験を行う価値があります。
 |
|
流体中のバイオマーカー。房水および/または血液に含まれる無細胞 DNA およびその他のバイオマーカーにより、体液生検は眼腫瘍学における従来の診断技術に代わる有望な代替手段となります。 |
「マルチオミクス」とAI
ゲノミクス、エピゲノミクス、プロテオミクス、RNA トランスクリプトミクスなどの「オミクス」全体に AI を適用することで、精密医療も大きく前進するでしょう。これらのデータはまとめて「マルチオミクス」と呼ばれます3。AIの進歩により、研究者はマルチオミクスを一緒に研究して、それらの相関関係、関連性、および診断と治療への影響を発見できるようになりました。3
膨大なオミクスデータ。がんは現在、人体の多数のオミックスデータ間の複雑な相互作用の結果であると理解されています。このデータには、推定 20,000 個のタンパク質、最大 22,000 個のタンパク質コード遺伝子、30,000 個の mRNA、114,100 個の代謝産物、およびその他の生物学的データが含まれています。イムノミクスとも呼ばれるイムノロミクス3 は、がんのもう 1 つの興味深いタイプのオミクス データ4です。これは、腫瘍が存在する環境を示すためです。このマルチオミクス データは、血液を含むあらゆる体液からのデータと組み合わせることができます。腫瘍が生成するのと同じ DNA、RNA、mRNA、タンパク質のビット。この知識により、各患者の固有のタイプの腫瘍を各身体の固有の環境で治療することにより、精密医療が進歩します。
今日のデジタル スライドと十分なクラウド ストレージにより、ほとんどの病理学者は大容量スキャナーでガラス スライドをデジタル スキャンし、デジタル スライドの巨大なデータベースを作成しています。AI は、これらのスライド データベースをマルチオミクス データ、患者画像、臨床データと組み合わせて、正確で効果的な治療法を備えた特定の疾患グループを作成し始めています。
精密医療。特定のがんに対する単一のバイオマーカーを発見することは刺激的ですが、将来の本当の進歩は、なぜある患者が治療に反応し、同様の患者が反応しないのかを理解するために、マルチオミクスデータの中からパターンを発見することから生まれる可能性があります。そこで、AI が眼の腫瘍学と病理学の将来に不可欠であることが証明されています。
機械学習と呼ばれるタイプの AI は現在、がんとそのサブタイプを分類し、患者の転帰と予後を予測し、さらには新しい治療薬を特定するためにマルチオミクス データに適用されています。3最終的には、個別化医療を微調整するために、社会経済的、地理的、その他の個人データさえもマルチオミクス研究に含めることができるでしょう。
具体的には、現在検討されている潜在的な AI アプリケーションでは、デジタル病理スライドのバーコードを作成して「がん」または「がんではない」というラベルを付け、患者の MRI、CT スキャン、OCT、血液化学検査、病歴などの他のバーコードを作成します。 。AI は、特定の治療によく反応した他の患者と類似した患者固有のマルチオミクス データを考慮して、その患者の診断、予後、治療を提案することができます。それが個別化医療のポイントです。全員を同じように扱うのではなく、個々の患者に合わせてケアを個別化することです。
現在、複数の研究者が複数の医療専門分野にわたるマルチオミクスに AI を適用しています。4目標は、患者について既知のすべてを統合した診断と治療であり、最終的には精密医療につながります。私たちはまさにその瀬戸際にいます。今後 5 年間で、この一部が実現する可能性があります。
____________________________
1 Berry JL et al. Mol Cancer Res. 2018:16(11):1701-1712.
2 Pike S et al. Ophthalmic Genet. 2022;43(6):855-861.
3 Biswas N, Chakrabarti S. Front Oncol. 2020;10:588221.
4 Rhee J et al. JACC CardioOncol. 2020;2(3):379-384.




コメント