清澤のコメント:アルツハイマー病と認知症の死体眼で、その眼内の変化を調査したという神経病理学雑誌の記事です。今週のAAOアジア太平洋版newsレターによれば。「網膜の変化は、軽度認知障害 (MCI) またはアルツハイマー病 (AD) と診断された死亡したドナーからの目と脳の組織サンプルを調べた多国籍研究の結果によると、アルツハイマー病の初期段階で見られます。 正常な認知を持つ対応する対照からの網膜組織と比較して、MCIまたはADのドナーからの組織は、既知のADバイオマーカーであるアミロイドβタンパク質(Aβ42)の有意な増加を示しました。 これらの知見は、網膜における Aβ42 の蓄積が AD の早期兆候である可能性があることを示唆している。 Acta Neuropathologica」
ーーーーー
元原稿の抄録と前文::Acta Neuropathologica
アルツハイマー病の網膜の病理学的特徴とプロテオーム シグネチャ
アルツハイマー病の網膜の病理学的特徴とプロテオーム シグネチャ
ヨセフ・コロニョ他 Acta Neuropathologica 145、409–438 ( 2023 )
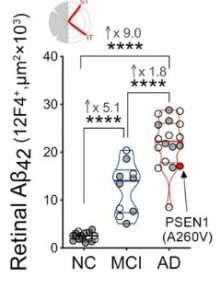
アルツハイマー病 (AD) の病理は、アクセス可能な神経感覚網膜で発見されています。しかし、特に機能障害の初期段階におけるその正確な性質と局所分布、およびそれらが脳内の疾患の進行とどのように関連しているかは、ほとんどわかっていません。網膜における AD の病理学的特徴をよりよく理解するために、86 人のドナーからの死後の網膜および脳組織の広範な組織病理学的および生化学的調査を実施しました。軽度認知障害 (MCI) および AD 患者の上側頭側網膜と下側側頭網膜を、正常な認知 (NC) の患者と比較して定量的に検査したところ、アミロイド β タンパク質 (Aβ 42)フォームおよび新規の神経内Aβオリゴマー(AβOi)は、網膜マクログリオーシス、ミクログリオーシス、および組織萎縮の悪化と密接に関連していました。これらの病状は、網膜層と幾何学的領域全体に不均一に分布しており、内層と周辺サブ領域は、MCI および AD 対 NC 網膜で最も顕著な蓄積を示しています。これらの患者の網膜ではミクログリア症が増加していましたが、Aβの取り込みに関与するミクログリア細胞の割合は減少していました。女性のAD患者は、男性よりも高いレベルの網膜ミクログリオーシスを示しました。特に、網膜 Aβ 42、S100 カルシウム結合タンパク質 B +マクログリオーシスおよび萎縮は、脳の Aβ 病理、タウオパチー、および萎縮の重症度と相関し、ほとんどの網膜病理は Braak 病期分類を反映していました。すべての網膜バイオマーカーは認知スコアと相関し、網膜 Aβ 42、遠末梢 AβOi およびミクログリオーシスが最も強い相関を示しました。AD網膜のプロテオーム解析により、特定の炎症および神経変性プロセスの活性化と、酸化的リン酸化/ミトコンドリアおよび光受容体関連経路の阻害が明らかになりました。この研究は、MCIおよびAD患者の網膜症を特定してマッピングし、脳の病理学および認知との定量的関係を示しており、ADの非侵襲的網膜スクリーニングおよびモニタリングのための信頼できる網膜バイオマーカーにつながる可能性があります。
序章
アルツハイマー病 (AD)、壊滅的な神経変性疾患、および世界中の罹患率と死亡率の主な原因 の病理学的プロセスは、脳に限定されるだけでなく、神経感覚網膜にも現れる. アルツハイマー病の特徴的な徴候、脳アミロイドβタンパク質(Aβ)プラーク、および過剰リン酸化(p)タウで構成される神経原線維変化(NFT)は、アルツハイマー病の確定診断の前提条件であり、臨床的認知症発症に数十年先行することが示されている。神経細胞の損傷が限られているADの初期段階で疾患を検出することで、早期の介入と治療効果の向上が可能になるはずです。早期診断と臨床モニタリングに関する現在の制限 により、網膜は、骨によって遮蔽されていない脳の発達拡張である 、直接的で手頃な価格の非侵襲的な視覚化と時間的モニタリングのための比類のないアクセシビリティを提供します。中枢神経系 (CNS) は、血管、細胞、および分子レベルの分解能で標的とする。したがって、網膜における AD の症状と脳の病理学との関係を調査することが優先されます。
初期の研究では、網膜神経節細胞 (RGC) の変性が説明され、AD 患者の死後網膜における Aβ 沈着、pTau、および NFT を含む AD 固有の病理が特定されました。その後の研究では、AD 脳と同様に、AD 患者の網膜が Aβ ペプチドとプラークの蓄積、血管内の Aβ 40とAβ 42沈着物、pTau 封入体、神経膠症、および周皮細胞とニューロンの変性を示すことが実証された 。 特に、これらの疾患の徴候は、多くの場合、上部側頭 (ST) および下部側頭 (IT) 周辺網膜領域で検出されます。私たちの以前の研究では、正常な認知 (NC) を持つ 7 人の AD 患者と比較して、8 人の AD 患者の ST フラット マウント網膜で Aβ 42 プラークが 4.7 倍増加し、8 人の網膜と脳のプラークの負荷の間に正の相関関係があることを発見しました。人体プラークを超えて、アルツハイマー病の脳から分離された可溶性Aβ オリゴマー (AβO) は、高いシナプスおよびニューロン毒性を発揮し、認知障害を引き起こす可能性がある。AβO は、AD の齧歯類モデルの網膜で実証されているが 、ヒト AD 網膜におけるその発現と、疾患状態との潜在的な関連性は調査されていない。さらに、AD 患者の脳では、Aβ プラークは通常、活性化ミクログリアや反応性星状細胞を含む周囲の炎症細胞と関連している。マウスADモデルの脳では、ミクログリアもAβクリアランス能力の低下を示すことがわかった。このグリア細胞の機能不全は、神経毒性、細胞老化、シナプスおよびニューロンの喪失の悪循環に寄与し、認知機能の低下につながる可能性がある。いくつかの研究では、AD 患者の網膜組織におけるグリア応答の増強の証拠が提供されているが 、 ADにおける網膜グリオーシスに関する私たちの知識は非常に限られており、脳グリオーシスと神経変性および認知の間の同様の相互関係も不明である。 AD網膜に存在します。
特に、非侵襲的網膜光学イメージングは、生きている AD患者のアミロイド斑、萎縮、および血管損傷を検出するために使用されています。パイロット研究では、認知機能が正常な個人よりも前臨床の AD 、軽度認知障害 (MCI)、または AD 認知症の患者で網膜アミロイド負荷が有意に高いことがわかっています。さらに、網膜アミロイド負荷の程度は、陽電子放出断層撮影法 (PET)で測定した脳アミロイド負荷、ならびに海馬および全灰白質萎縮および言語記憶障害と相関することがわかっている。 .
網膜イメージングの進歩とAD病理の部位としての神経網膜の特定が行われたが、網膜の病態生理学的プロセスと、疾患の予測に使用できる網膜と脳の病理の間の潜在的なリンクの理解にはまだギャップがある。Aβの蓄積や関連する神経膠症、神経変性などの主なADプロセスは、機能障害(MCI)の発症時に網膜、特に末梢部分領域で発生し、疾患がAD認知症に進行するにつれて悪化するという仮説を立てた。網膜の病理の程度は、脳の病理と認知機能低下の重症度を示していると予想された。網膜のADプロセスをより深く理解するために、我々は、決定的なAD認知症を有する患者ドナーおよびMCI(ADによる)患者ドナーからの網膜組織におけるこれらの病理学的変化の探索的組織学的および生化学的調査を、NC個人(n = 54)と比較して実施した 。ニューロン内の AβO (AβOi) 種を特定し、Aβ 42および AβOi 種、グリア線維性酸性タンパク質 (GFAP) +および S100 カルシウム結合タンパク質 B (S100β) +マクログリオーシス、イオン化カルシウム結合アダプター分子 1の負荷と時空間分布、 (IBA1) +ミクログリオーシス、および網膜断面の事前定義されたサブ領域における組織萎縮を決定した。。さらに、網膜と脳の間の接続を調査するために、これらの網膜の病理、対になっている脳の病理の重症度 (例、Aβ プラーク、NFT、ニューロパイル スレッド [NT]、萎縮、および Braak ステージ)、および認知障害の間の相関関係を評価した。 重要なことに、これらの網膜異常が機能障害の初期段階、つまりMCI患者の網膜に存在するかどうかを調査した。私たちの発見をさらに解明するために、NCコントロールと比較して、AD患者の網膜および脳組織の全体的なプロテオミクスプロファイルを調査しました(n = 32)。私たちのデータは、網膜のADに固有の早期かつ実質的な病理学的変化を明らかにしました。これは、特定の幾何学的領域で特に顕著であり、脳の病理学および認知状態と密接に関連している。
清澤注:プロテオミクス(proteomics):ゲノム科学の進展とともに、タンパク質料学を系統的・包括的にとらえようとする研究領域が発達してきた。これをプロテオミクスと呼ぶ。狭義の意味は、プロテオーム解析を行うための、タンパク質の大規模・同時分離と、高効率・高感度同定技術を指した。その実際は2次元電気泳動と質量分析法(マス・スぺクトロメトリー)であった。しかし、1990年代の終わりから、研究分野の拡大とともにタンパク質の大規模解析を前提とする、総合的タンパク質科学全体を指すようになった。この観念と方法論は、細胞機能の研究法としてだけではなく、臨床医学や薬理学,創薬のための高度医療技術としても注目されている。




コメント