 清澤のコメント;高橋政代先生の記事にあったように、現在の日本の保険医療保険制度の下では、日本国内で新たなっ治験を行うことのメリットが製薬会社側に乏しく、ドラッグロスが起きているという話を聞いていました。私費であっても選定医E886B5E88793E381AEE38197E3818FE381BF.jpg療などでこのような希用薬が使えるようになるとよいのではないかと思いました。
清澤のコメント;高橋政代先生の記事にあったように、現在の日本の保険医療保険制度の下では、日本国内で新たなっ治験を行うことのメリットが製薬会社側に乏しく、ドラッグロスが起きているという話を聞いていました。私費であっても選定医E886B5E88793E381AEE38197E3818FE381BF.jpg療などでこのような希用薬が使えるようになるとよいのではないかと思いました。新たな標準治療が登場へ
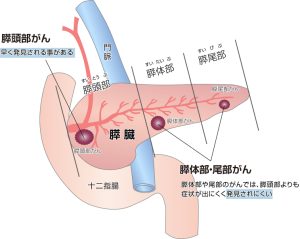
この状況の中、膵癌の薬物治療に大きな変化をもたらす発表が、2023年1月に米国サンフランシスコで開催された、2023 ASCO Gastrointestinal Cancers Symposium(ASCO GI 2023)で行われた。NAPOLI-3試験という第3相臨床試験の結果だった。
NAPOLI-3試験は、未治療の転移を有する膵管腺癌(PDAC)を対象に、ナノリポソーム型イリノテカン(Nal-IRI)と5-FU/ロイコボリン、オキサリプラチンを併用する群(NALIRIFOX群)と現在の標準治療であるゲムシタビン+nab-パクリタキセルを投与する群(Gem+NabP群)を比較した試験だった。試験の結果、全生存期間(OS)中央値はNALIRIFOX群11.1カ月、Gem+NabP群が9.2カ月で、ハザード比は0.83、p=0.04と有意にNALIRIFOX群で生存を延ばす効果が確認された。しかも腫瘍の縮小が30%以上認められ、「奏効」となった患者は41.8%と、40%を超えた点も研究者から注目を集めた。
この試験は、進行膵癌で有用性が示された久しぶりの第3相試験で、世界的にはNALIRIFOXが1次治療の標準治療になっていくことが確実となった。また、奏効率が4割を超えたことで、術前・術後補助療法としても検討され、膵癌治療を今後大きく変えることが期待されている。
膵癌治療で後れをとる日本
ところが、日本にとって大きな問題となることがある。NAPOLI-3試験に日本の施設は参加していなかったことだ。現在、Nal-IRIは日本において膵癌の2次治療以降に使う薬剤として承認されている。この2次治療で使えるようになるまでにも日本は時間がかかった。Nal-IRIと5-FU/ロイコボリン(LV)の併用が膵癌の2次治療以降で有効であることを示した第3相NAPOLI-1試験にも日本は参加してなかった。そのため、別途日本人での安全性を見る第2相試験が行われてから承認された。
今回も同様の状況を迎えている。これから試験を立ち上げて実施すると、結果が出るのは2年から3年先。承認までは早くとも3年強かかることになる。膵癌が増えている中で、世界の1次治療の標準治療となるNALIRIFOXが日本では使えない状況が当面続くことになる。。。
今、海外で使える抗癌薬が日本で使えないドラッグロスが問題となっている。ベンチャー企業の薬剤開発試験に日本の施設が参加できていないといった問題点が指摘されている。、、




コメント