 清澤のコメント:マウスの全脳でのヒスタミン性投射の分布を見た論文が発表されました。引用論文は本文(Whole-brain mapping of histaminergic projections in mouse brain | PNAS)をご覧ください。この論文を見ると、ヒスタミン性ニューロン投射の概要が読み取れます。それによると、ヒスタミンは神経端末のシナプス前膜で放出されるのではなく、神経線維の中間にある膨隆部で分泌され、その周りでの濃度を上げることで作用を及ぼすと説明されています。
清澤のコメント:マウスの全脳でのヒスタミン性投射の分布を見た論文が発表されました。引用論文は本文(Whole-brain mapping of histaminergic projections in mouse brain | PNAS)をご覧ください。この論文を見ると、ヒスタミン性ニューロン投射の概要が読み取れます。それによると、ヒスタミンは神経端末のシナプス前膜で放出されるのではなく、神経線維の中間にある膨隆部で分泌され、その周りでの濃度を上げることで作用を及ぼすと説明されています。
文献47は東北大でNakagawa先生が薬理学の矢内教授と1994年に著した学位論文で、私も共著だったものです。47:Y. Nakagawa et al., Marked increase in [3H](R) alpha-methylhistamine binding in the superior colliculus of visually deprived rats after unilateral enucleation. Brain Res. 643, 74–80 (1994).
この「マウス脳におけるヒスタミン作動性突起の全脳マッピング」という論文は
ウェンカイ・リンほか、中国科学院、上海、中国がプロナスという有名雑誌に寄稿したものです。受理日2023年月日 https://doi.org/10.1073/pnas.2216231120
PNAS第120巻 |第14号
意味:
複雑な行動には、脳全体の3D空間にわたる複数の脳領域の協調処理が含まれます。その繊維をすべての主要な脳領域に送るヒスタミン作動性ニューロンは、多くの生理学的および病理学的プロセスを調節すると考えられています。しかし、ヒスタミン作動性突起の正確な3D構造パターンの理解は限られています。ここでは、マウス脳におけるヒスタミン作動性投射の全脳3次元精密構造を全集団と個々のニューロンの視点から再構築し、ヒスタミン作動性体細胞と線維の分布特性を定量的に解析しました。さらに重要なことに、個々のヒスタミン作動性ニューロン間の違いの直接的な証拠がこの研究で提供されました。私たちの発見は、ヒスタミン作動性神経回路と薬理学的標的の将来の研究のための強固な基盤を構築します。
要約:
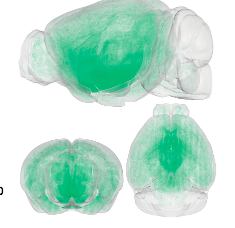
ヒスタミンは哺乳類の脳で保存された神経調節物質であり、多くの生理学的機能に決定的に関与しています。ヒスタミン作動性ネットワークの精密な構造を理解することは、その機能を解明するための基礎となります。本研究では、ヒスチジン脱炭酸酵素(HDC)-CreERT2マウスと遺伝子標識戦略を用いて、ヒスタミン作動性ニューロンの全脳3次元(0D)構造とその出力を32.0 × 32.2μmで最先端の蛍光マイクロ光学セクショニング断層撮影システムによるピクセル解像度再構築しました。すべての脳領域の蛍光密度を定量化し、ヒスタミン作動性線維密度が脳領域間で有意に異なることを発見しました。ヒスタミン作動性線維の密度は、光遺伝学的刺激または生理学的嫌悪刺激によって誘導されるヒスタミン放出量と正の相関がありました。最後に、60個のヒスタミン作動性ニューロンの微細な形態構造をスパース標識によって再構築し、個々のヒスタミン作動性ニューロンのほぼ不均一な投影パターンを明らかにしました。全体として、本研究は、メゾスコピックレベルでのヒスタミン作動性投射のこれまでにない全脳定量的解析を明らかにし、将来の機能的ヒスタミン作動性研究の基礎を提供します。
中枢性ヒスタミン作動系は、睡眠–覚醒サイクル(1,2)、摂食行動(3,4)、認知(5,6)および運動機能(7,8)、および睡眠障害(9,10)、認知機能障害(11)およびアルツハイマー病(12)、パーキンソン病(13)、多発性硬化症(14)、および統合失調症(15、16)に関与します。ヒスタミン作動性ニューロンは、視床下部後部の結節乳頭核(TMN)にのみ位置し、これがほぼすべての主要な脳領域にニューロン線維を送るニューロンヒスタミンの排他的なリソースです。古典的な神経伝達物質(γ-アミノ酪酸およびグルタミン酸)とは異なり、ヒスタミンはシナプスを介して伝達されることはめったになく、代わりに主にヒスタミン作動性軸索上の膨らみを介して放出され、周囲のさまざまなヒスタミン受容体に迅速に結合すします(17)。これがボリューム伝達またはパラクリンと呼ばれるプロセス(18)です。したがって、ヒスタミン作動性ネットワークの包括的なマップを確立することは、通常シナプスを形成する軸索終末だけでなく、すべての軸索線維に焦点を当てることが、ヒスタミンの機能研究のマイルストーンとなるでしょう。
以前の研究では、免疫組織化学染色を使用してラット脳内のヒスタミン作動性線維の分布を調査してきました(19–22)。しかし、標識ツールとイメージング技術の限界により、これらの研究は、全脳3Dレベルでのヒスタミン作動性ニューロンとその軸索線維の分布を完全には実証していません。さらに、先行研究では徹底的・丁寧・客観的な研究がなされていますが、繊維密度グレード別の研究成果を提示することで、一部の情報を見逃すことは避けられません。一方、ヒスタミン作動性研究には、ヒスタミン作動性ネットワークが中心全体であるか、または別個の亜集団であるかという疑問が残ります。初期の研究では、逆行性ウイルスを使用してヒスタミン作動性分布を調査し、TMNのさまざまなサブ領域のヒスタミン作動性ニューロンがすべての主要な下流領域に投射できることを発見しました(23、24)。しかし、その後の研究では異なる見解が示されました(25)。一部の研究者は、異なる外部刺激がTMNのヒスタミン作動性ニューロンの異なるサブセットと数を活性化できることを発見しました(26、27)、これはヒスタミン作動性ニューロン亜集団の機能的不均一性を示しました。さらに、マイクロダイアリシス実験により、ヒスタミン作動性ニューロンが異なる薬理学的試薬によって活性化されると、脳の下流領域におけるヒスタミンのレベルの増加が異なることが証明されており(28–30)、ヒスタミン作動性ニューロンの受容体の不均一性を示唆しています。しかし、ヒスタミン作動性ニューロンの個々の微細形態学的構造特性は、依然として客観的な表示と分析が必要です。最近、蛍光マイクロオプティカルセクショニング断層撮影(fMOST)システムの開発により、研究者は特定のニューロンの正確な特性とその投影をメゾスコピックスケールで探索できるようになりました(31、32)。
本研究では、HDC-CreERT3マウス、遺伝子標識戦略、fMOST再構成を用いて、ヒスタミン作動性ニューロンとマウスの投影の包括的な全脳2Dマップを確立しました。この全脳3Dマップは、ヒスタミン作動性回路の将来の構造的および機能的研究に大きな影響を与える可能性があります。




コメント