良いアイデアはダメになった: MIRAgel の事例
(Good Ideas Gone Bad: The MIRAgel Saga (aaojournal.org))
ジョン・T・トンプソン他
Crama と Klevering による記事では、ハイドロゲル上強膜インプラント (MIRAgel; MIRA、Inc.、マサチューセッツ州ウォルサム)は、467 眼に強膜バックルとして使用されました。
これは、MIRAgel インプラントの合併症について報告された最大のシリーズであり、これらのインプラントがどのようにゆっくりと膨張し、最終的に眼窩腫瘤、眼球外運動障害、バックル露出、眼内合併症を引き起こすかを示しています。 MIRAgel 強膜バックルの拡大は徐々に増大したため、患者は網膜剥離後 5 ~ 10 年経過するまで問題を経験しませんでした。
MIRAgel インプラントによる合併症の話は、製品が最初に市場に提案される時点では通常、長期にわたる研究が利用できないため、新薬や機器の安全性を確立することの限界を示しています。
ハイドロゲル強膜バックルは 1980 年代に初めて市販され、以前の強膜バックル素材を改良するために開発されました。 初期の研究では、2 年間の追跡調査でインプラントの長期安全性が主張されました。MIRAgel デバイスの導入前、強膜バックルはシリコーン スポンジまたはシリコーン ゴムで構成され、次のように設計されていました。
それは、強膜の外側または強膜内に縫着します。 代わりに MIRAgel はスポンジ状の素材です。 これらのスポンジ状のバックルは、スポンジの孔が親水性であり、移植前に抗感染症溶液に浸しておけば抗感染症薬を蓄えることができるため、有望であると考えられた。 これは強膜バックル感染症の発生率を減らすのに役立つ可能性があると考えられていました。 バックルは手術後にわずかに膨らむため、バックリング効果が増大することが知られており、理論的には網膜の再付着を維持するのに役立つため、これは望ましいと考えられていました。
MIRAgel 強膜バックルは、食品医薬品化粧品法の機器改正が制定される前に市販されていた製品と実質的に同等であると考えられたため、1980 年代に販売が許可された製品群の一部です。 これらの装置の多くは 1980 年代後半に埋め込まれましたが、報告によると、MIRAgel インプラントの問題は、一般に、埋植後 5 年以上経過するまで認識されませんでした。
1995 年と 1996 年に、MIRAgel インプラントの進行性膨張に関する多数の追加の有害事象報告が食品医薬品局によって受理されました。1996 年に、MIRA はバックルに使用される素材を変更しました。
MIRAgel バックルは、認識されていない晩期合併症を引き起こす有望な眼科用デバイスの唯一の例ではありません。 この問題の他の例は、承認されたことはありませんが、エピケラトファキア レンズと虹彩クリップ レンズの使用でした。 (エピケラトファキア レンズと虹彩クリップ レンズ部分は省略)
食品医薬品局の規制当局は、継続的にこの課題に直面しています。 研究を長期化すると、追加の安全性と有効性の情報が得られますが、研究が長期化すると費用がかかり、有望な新しい治療法の利用可能性を遅らせる。 慎重に管理された研究は、インフォームドコンセントを受けた少数の患者に対する潜在的な損傷を制限するように設計できます。 しかし、臨床試験に参加する患者の数が比較的少ないため、患者を特定することは不可能です。研究が長期化すると、追加の安全性と有効性の情報が得られますが、研究が長期化すると費用がかかり、有望な新しい治療法の利用が遅れます。 製品が承認されると、より広範囲の治療法が利用できるようになりますが、より多くの患者が傷害の危険にさらされることになります。 最終的には、リスクを許容しながら製品を承認できるバランスをとらなければなりません。 新しい技術の最先端にいることに誇りを持っている眼科医にとって、新しい薬、装置、または治療法が利用可能になるたびに、いくつかの重要な質問をすることが重要です。 まず、新しい治療法は本当に既存の治療法よりも優れているのでしょうか? 既存の治療法の成功率が高く、合併症が少ない場合、眼科医は長期的な結果が得られるまで新製品に対してより慎重になるべきです。 MIRAgel 強膜バックル、エピケラトファキア、虹彩クリップ IOL、およびその他の製品の経験から、新製品の市販後調査を拡大することの重要性も強調されています。 食品医薬品局による手術用器具および医薬品の承認プロセス 米国の行政や世界の他の地域の規制当局は通常、1 ~ 2 年間続く臨床試験の結果に基づいています。 新製品によって数年間は発生しない合併症が発生した場合、眼科医はこれらの合併症をメーカー、科学文献、規制当局に報告することが不可欠です。 これらの合併症の報告を照合することで、新製品の安全性と有効性プロファイルをより正確に把握できます。 長期的な合併症について入念に報告することは、良いアイデアがいつダメになるかを特定し、患者に対する最も効果的で安全な製品の使用を促進するのに役立ちます。
ーーーーーー

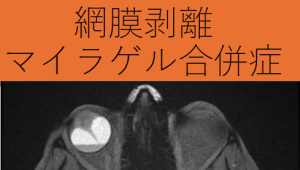 マイラゲル(MIRAgel)について:。マイラゲルは、1980年代にシリコーン材料の代替として網膜剥離のバックル材料として導入されました。しかし、術後長期間を経た後に、シリコーン材料とは異なる症状を伴って問題が発生することがありました。
マイラゲル(MIRAgel)について:。マイラゲルは、1980年代にシリコーン材料の代替として網膜剥離のバックル材料として導入されました。しかし、術後長期間を経た後に、シリコーン材料とは異なる症状を伴って問題が発生することがありました。


コメント